Razumijevanje kemije slatkovodnih akvarija
- Detalji
- Napisao/la Franjo Jović, dipl. kem. inž.
- Hitova: 40998
 Svaki akvarist nastoji postići savršenu ravnotežu u svome akvariju. S obzirom da je riječ o vodenom sustavu postoje brojne ravnoteže koje nastojimo održati. Prije svega glavni je indikator ravnoteža rasta i razmnožavanja biljaka i životinja. Da bi ona bila ispunjena moraju biti ostvareni nužni uvjeti koji uključuju kemijske ravnoteže: otopljene ione (pozitivno nabijene - katione i negativno nabijene - anione), otopljene plinove, zatim kiselost, i napokon organske otpadne tvari. U otvorenom vodenom sustavu ovi parametri su pod kontrolom složenog sustav samoreguliracije koje se temelje na prirodnim kontrolnim mehanizmima (protočni uvjeti, atmosferski utjecaj itd.). U zatvorenom vodenom sustavu samoregulacija nije toliko izražena i u najboljem se slučaju ostvaruje ako se sustav adekvatno održava. Pravilno održavanje akvarija stoga zahtijeva našu intervenciju. Zato su nam potrebni grijači, filteri, osvjetljenja itd. Ipak potrebno je i nešto znanja koje uključuje primjenu jednostavnih kemijskih načela, pa iako se akvarij može održavati bez razumijevanja primarnih načela, bolje uravnoteženje nekih od navedenih parametara možemo postići boljim razumijevanjem. U tom ćemo slučaju bolje znati što nam je činiti i zašto to činiti. Osim toga što više razumijemo, to ćemo vjerojatnije biti u mogućnosti izbjeći katastrofu i biti uspješniji.
Svaki akvarist nastoji postići savršenu ravnotežu u svome akvariju. S obzirom da je riječ o vodenom sustavu postoje brojne ravnoteže koje nastojimo održati. Prije svega glavni je indikator ravnoteža rasta i razmnožavanja biljaka i životinja. Da bi ona bila ispunjena moraju biti ostvareni nužni uvjeti koji uključuju kemijske ravnoteže: otopljene ione (pozitivno nabijene - katione i negativno nabijene - anione), otopljene plinove, zatim kiselost, i napokon organske otpadne tvari. U otvorenom vodenom sustavu ovi parametri su pod kontrolom složenog sustav samoreguliracije koje se temelje na prirodnim kontrolnim mehanizmima (protočni uvjeti, atmosferski utjecaj itd.). U zatvorenom vodenom sustavu samoregulacija nije toliko izražena i u najboljem se slučaju ostvaruje ako se sustav adekvatno održava. Pravilno održavanje akvarija stoga zahtijeva našu intervenciju. Zato su nam potrebni grijači, filteri, osvjetljenja itd. Ipak potrebno je i nešto znanja koje uključuje primjenu jednostavnih kemijskih načela, pa iako se akvarij može održavati bez razumijevanja primarnih načela, bolje uravnoteženje nekih od navedenih parametara možemo postići boljim razumijevanjem. U tom ćemo slučaju bolje znati što nam je činiti i zašto to činiti. Osim toga što više razumijemo, to ćemo vjerojatnije biti u mogućnosti izbjeći katastrofu i biti uspješniji.
Voda
Kada u kolokvijalnom govoru raspravljamo o vodi mislimo na vodu sa u njoj svim otopljenim tvarima. Stupanj čistoće vode ovisi o količini tih otopljenih tvari. Kako je voda polarno otapalo (vidi jednadžbu 1.), ona će disocirati na pozitivne hidronijumske ione (H3O+ ili češće samo H+, i negativne hidroksilne ione, OH-).
2H2O ↔ H3O+ + OH- jednadžbe disocijacije
Otopljene tvari u vodi su uvijek u ravnoteži (kemijskoj ili fizikalnoj). Kemijska ravnoteža implicira ravnotežu između reaktanata (polaznih tvari) i produkata. Fizikalna ravnoteža implicira ravnotežu jedne tvari između različitih faza ili agregatnih stana, npr. ravnoteža para-kapljevina i sl.
Količina otopljenih tvari u vodi se izražava koncentracijom. Koncentracija se definira kao omjer konstitutivnih jedinica neke tvari podijeljena s ukupnom količine smjese (otopine). Najčešće koncentracije koje se koriste u kemiji su: masena koncentracija (γ = [g m-3]) i molarna koncentracija (c = [mol m-3]). Pojam koncentracija može se primijeniti na bilo koju vrstu mješavina kemikalija, ali najčešće se odnosi na otopljene tvarima u homogenim otopinama .
Primjer. Otapanje amonijaka (NH3) u vodi.
Kada uvodimo amonijak (NH3) u vodu on najprije mora prijeći iz plinovitog u kapljevito (tekuće) fazno (agregatno) stanje.
NH3(plin) ↔ NH3(tekućina) jednadžba otapanja
Relativna ravnoteža između dva oblika je opisana konstantom ravnoteže, K.
Ko = c(NH3)tekućina/c(NH3)plin
Otapanjem amonijaka (NH3) u vodi dolazi do kemijske reakcije sa vodom pri čemu nastaje NH4+, Transformacija jednog oblika u drugi, i natrag, rezultat je ravnoteže.
NH3 + H2O ↔ NH4+ + OH- jednadžba disocijacije
Ova ravnoteža je određena omjerom koncentracije kemijskih produkata i koncentracije kemijskih reaktanata.
Kr = c(NH4+)*c(OH-)/c(NH3)c(H2O)
Ravnoteža
Le Chatelierov princip govori o ravnoteži u sustavima i glasi:
Ako sustavu promijenimo neku veličinu, sustav će nastojati tu promjenu umanjiti.
U kemiji se Le Chatelierov princip koristi kako bi se predvidjela i upravljala neka povratna kemijska reakcija.
Isti se princip koristi i u biologiji i ekonomiji.
Ukoliko se u nekom šumskom području poveća broj kukaca, povećat će se i broj životinja koje te kukce jedu, čime priroda nastoji spriječiti novonastalu promjenu. Očito je da se Le Chatelierovo načelo može primjeniti i u svakodnevnom životu, a ne samo u kemiji.
Otopljene tvari u vodi
Voda će otapati ionski aktivne tvari, pa kažemo da će ih voda hidratizirati (akvatizirati). Katione će se u vodi okružiti hidroksilnim ionima, OH-, a anioni s hidronijum ionima, H+, prema Coulombovom zakonu ('+' voli '–'). Soli (anorganske, mineralne) se dakle otapaju u vodi i time prelaze u svoje ionske oblike npr. kuhinjska sol:
NaCl + H2O → Na+(aq) + Cl-(aq)
Voda će otapati u plinove, a količina otopljenog plina će ovisiti o parcijalnom tlaku tog plina iznad otopine. Ovaj zakon je poznat i Henryjev zakon i matematički se može opisati jednadžbom:
cA = K pA
Henryjev zakon govori da će koncentracija otopljenih plinova u vodi (npr. kisika, O2 i ugljičnog dioksida, CO2) biti proporcionalan parcijalnom tlaku (količini) koji upuhujemo u vodu. I ukoliko postignemo ravnotežnu koncentraciju koja ovisi o konstanti topljivosti (koja ovisi o temperaturi) bez obzira na količinu upuhanog zraka (O2 ili CO2) ta koncentracija neće rasti.
U vodi mogu biti otopljene organske tvari, a o njima ne govori niti vodljivost vode niti pH. Drugim instrumentalnim tehnikama možemo saznati o količini organskih tvari (npr. kromatografske metoda). Organske tvari ne disociraju. Polarne organske tvari se dobro otapaju u vodi (npr. alkoholi), dok se nepolarne uopće ne otapaju (npr. ulje).
Mikrobiološka čistoća vode govori o sadržaju mikroorganizama u vodi. Mikrobiološki čistu vodu nazivamo sterilnom. Dodatak nekih tvari kao npr. klora u vodovodnoj vodi uništavamo mikrorganizme i time je činimo prikladnom za ljudsku upotrebu. Na žalost takva voda (sterilna) nije prikladna za život vodenih bića pa ju je potrebno kondicionirati (ukloniti spojeve s klorom)
pH vrijednost
Prvo, što je kiselina?
Što je baza (lužina)?
Kiseline su definirane kao tvari koje su sposobne donirati ion vodika, a baze kao tvari koje prihvaćaju ion vodika. Kiseline i baze mogu biti jake ili slabe. Jake kiseline (HCl, H2SO4, HNO3) bit će potpuno disocirane (ionizirane) kada se dodaju u vodu. Dakle u vodi neće biti molekule solne kiseline nego samo klorovi ioni (kloridi, Cl-) i vodikovi ioni (H+) (vidi jednadžbu).
HCl + H2O ↔ H3O+ + Cl-
Slabe kiseline (CH3COOH, H2CO3) su kiseline koje otapanjem u vodi slabo disociraju, što znači da u otopini postoji značajna količina molekula kiseline koje nisu disocirane.
Jake baze (NaOH, KOH, Ca(OH)2) su također potpuno disocirane, a slabe baze (NH4OH) također djelomično disocirane.
Soli jake baze i slabe kiseline reagiraju lužnato, dok soli jake kiseline i slabe baze reagiraju kiselo zbog procesa koji se naziva hidroliza.
Primjer. CaCO3 najčešča sol koja se pojavljuje u akvaristici i koja čini tvrdoću vode. Kako je karbonatna kiselina slaba kiselina i djelomično je disocirana, a sol potpuno disocirana time će karbonati iz vodene otopine "trošiti" vodikove ione (H+) i zaluživati vodu (vidi jednadžbu).
CaCO3 + H2O ↔ Ca2+ + CO32- + H2O ↔ Ca2+ + HCO3- + OH-
disocijacija hidroliza
Mjera kiselosti (lužnatosti) vodene otopine je pH vrijednost. pH vrijednost je logaritamska veličina koncentracije hidronijum iona (H+). S obzirom da se uzima negativna vrijednost logaritma, pH se kreće od veličine 1 do 14 (Slika 1.). Ako je pH vrijednost neke vodene otopine manja od 7 tada smatramo tu otopinu kiselom, a ako je veća od 7 tada se ona smatra lužnatom. pH vode je točno 7 i ona se smatra neutralnom.
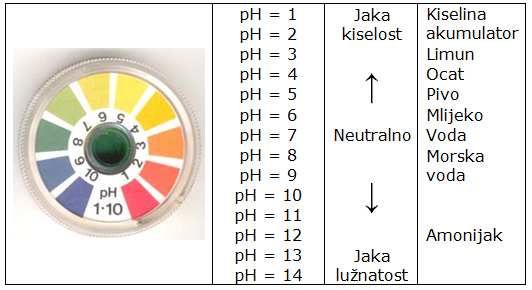
Primijetite da je pH vrijednost logaritamska ljestvica, što znači da se za dvije tvari od kojih jedna ima pH 4, a druga pH 6 koncentracija H+ iona ne razlikuje 2 nego 100 puta. pH vode pri 25 °C jest 7. pH se može odrediti na više načina. Najpogodniji je univerzalni indikatorski papir, a za precizno određivanje koriste se pH metri.
Tvrdoća vode
Količina otopljenih tvari se izražava koncentracijom. Kako je u vodi otopljeno mnogo tvari onda je neprikladno izražavati količinu otopljenih tvari s koncentracijama već to činimo s izvedenom jedinicom koju nazivamo ukupna tvrdoća. Ukupna tvrdoća (GH-General Hardness) izražava se jedinicom stupanj °dH (1 °dH → γ(CaCO3) = 17,86 mg dm-3). Što je manja vrijednost ukupne tvrdoće (manja količina soli) takvu vodu nazivamo mekšom, a veća vrijednost je određuje kao tvrdu vodu (tablica 1.).
Stalna tvrdoća se odnosi na sulfate i kloride kalcija i magnezija. A promjenjiva ili karbonatna (KH-Carbonate Hardness) tvrdoću koja dolazi od karbonata kalcija i magnezija.
Tablica 1. Tvrdoća vode
| Tvrdoća °dH | Kvaliteta vode |
| 0 - 5 | vrlo meka |
| 5 - 10 | meka |
| 10 - 15 | umjereno tvrda |
| 15 - 25 | tvrda |
| preko 25 | tvrda |
Da bi suštinski shvatili karbonatnu tvrdoću vode potrebno je objasniti vezu između otopina soli slabih kiselina i jakih lužina. Otapanjem soli NaCl (sol jake kiseline i jake lužine) otopina će pokazati neutralnu reakciju. Otopina CaCO3 (sol jake lužine i slabe kiseline) će biti lužnata zbog hidrolize, a kisela otopina CaCO3 će pokazati pufersko djelovanje (odupire se promijeni pH).
Pufer se sastoji od dva dijela: (1) slaba kiselina ili baza, i (2) sol koja slabe kiseline ili baze. Konstanta ravnoteže za slabe kiseline će nastojati zadržati pH stalnim. Sol slabe kiseline omogućuje nam postaviti željeni pH namještanjem omjera s konjugirana bazom (anionski dio soli slabe kiseline).
Primjer. Tvrda akvarijska voda (Bikarbonatni pufer)
Bikarbonatni pufer uključuje sol karbonatne kiseline (kalcij bikarbonat, CaCO3) i slabu kiselinu (ugljičnu kiselinu, H2CO3), koja nastaje kao produkt otapanja ugljičnog dioksida (CO2). Ovo je primjer veze između pH, karbonatne tvrdoće vode i otopljenog CO2. To su tri parametra koja su nedjeljiva kada je riječ o ravnoteži akvarijske vode, a ravnoteže su prikazane jednadžbama:
CO2 + 2 H2O ↔ H2CO3 ↔ H+ + HCO3- ↔ 2H+ + CO32-
Ukoliko imamo tvrdu vodu (veliki sadržaj karbonata) teško ćemo moći smanjiti kiselost vode (dakle smanjiti pH), jer će se Le Chatelierov princip opirati toj promjeni. H+ ioni će se "trošiti" na reakciju s karbonatima (hidroliza), pri čemu će se u konačnici oslobađati CO2 iz vode. Povećavanje sadržaja H+ iona neće zakiseliti vodu nego će neutralizirati karbonate, a smanjenje sadržaja H+ iona će disocirati karbonatnu kiselinu kao je prikazano jednadžbama:
Pufer (H2CO3 + CaCO3)
Povećanje H+ (npr. "pH minus" sredstvo) → 2H+ + CaCO3 ↔ H2CO3
Smanjenje H+ (npr. dodatak vodovodne vode) → OH- + H2CO3 ↔ H2O + HCO3-
Korištenje bikarbontnog pufera može biti poprilično nezgodno zbog jedinstvenog aspekt koji se ne nalazi u drugim puferskim sustavima. Normalno je da nastaje ili se gubi komponenta kiseline u puferu s promjenama u pH kako je to prikazano jednadžbama. No u bikarbonatnom puferu komponenta kiseline (ugljična kiselina) može nastati ili nestati sa promjenama CO2 koncentracije. Na koncentraciju CO2 utječu temperatura, aeracija, ili parcijalni tlak CO2 iznad vode (Henryjev zakon). To nas vraća natrag na LeChatelierov princip> ukoliko povećamo koncentraciju CO2 u sustavu (npr. uvođenjem u akvarij) sustav će naše djelovanje nastojati poništiti. To će napraviti tako što će nastajati više karbonata (povećavat će se karbonatna tvrdoća vode), dok se ponovno ne uspostavi ravnoteža.
Smanjenje emisija CO2 u vodi će rezultirati smanjenjem ugljične kiseline u vodi. Ova činjenica može poslužiti pri tretiranju vodovodne vode koja je tvrda, dakle za omekšavanje vode. Zagrijavanjem vode smanjuje se topljivost CO2 koji hlapi iz otopine taložeći kalcijev karbonat prikazano jednadžbom:
Ca2+ + 2HCO3- → CaCO3 ↓ + CO2 ↑ + H2O
Grijanjem vodovodne vode smanjuje se topljivost svih plinova (klora i kloramina) koji time hlape iz vode što također može biti korisno pri tretiranju vode (uklanjanju opasnih tvari iz vode).
Čistoća vode
Kada govorimo o čistoći vode, govorimo o količini otopljenih tvari u njoj, pa tako imamo ionski aktivne tvari.
Mjera količine otopljenih tvari je vodljivost vode. Što je više otopljenih ionskih tvari to će voda biti električki vodljivija. pH je također dobar indikator o količini ionski topljivih tvari. Morska voda sadrži oko 3,5% soli i još neke otopljene tvari i električki je jako vodljiva.
Kvaliteta vode ovisi o parametrima vode (vidi tablicu 2.).
Tablica 2. Vrste vode prema čistoći i pripadajući parametri
| Kvaliteta | Ultra-čista voda | Čista voda | Pročišćena voda | Pitka voda |
| Otpornost/ MΩ cm |
10 – 18 |
1 – 10 |
1 – 0,02 |
< 0,02 |
| Vodljivost/ μS cm-1 |
0,1 – 0,0555 | 1,0 – 0,1 | 1 - 50 | > 50 |
Načini pročišćavanja vode
Čišću vodu možemo dobiti ovisno o fizikalno-kemijskoj metodi separacije ionskih tvari iz vode.
Tako postoje:
1. Destilirana voda (ili redestilirana)
Dobiva se destilacijom vode – isparavanjem vode, pa ukapljivanjem vode u drugoj posudi pri čemu otopljene tvari zaostaju u prvoj posudi (Slika 4.). Destilirana voda može sadržavati male količine hlapljivih nečistoća. Destilacija konvencionalnim metodama zbog velike potrošnje energije prilično je skup postupak.
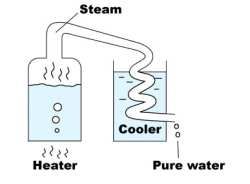
Slika 4. Destilacija vode
2. RO voda (Voda dobivena reverznom osmozom)
To je voda dobivena filtracijskim tehnikama reverzne osmoze. Kroz polupropusnu membrenu se narine tlak tako da se prijenos tvari (vode) odvija suprotno difuziji, pa se dio vode koncentrira sa ionima (manji dio), a dio se pročišćava od iona (slika 5.). RO voda još uvijek sadrži male količine ione. Zbog velikog tlaka zanju stradati RO membrane.
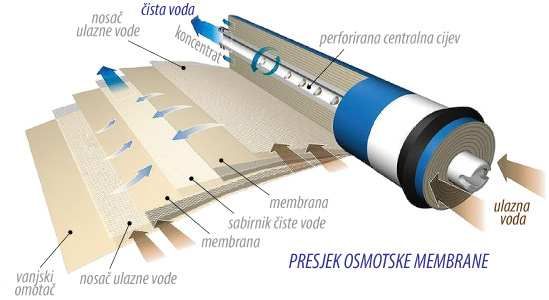
Slika 5. Presjek osmotske membrane
(http://www.nobelnekretnine.hr/filteri/Pics/shema-osmoza.jpg)
3. Demi voda (demineralizirana voda)
Demi voda je voda koja je provučena kroz ionske izmjenjivače – najprije kationski izmjenjivač koji izmjenjuje katione sa H+ ionima, a zatim anionski koji mijenja anione sa OH- ionima. Voda visokog stupnja čistoće (ultra čista). Ovisno o količini otopljenih tvari potrebno je povremeno regenerirati ionske smole, i kationski sa koncentriranom kiselinom, a anionski sa lužinom.
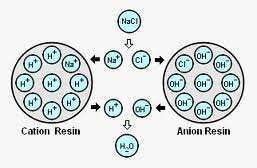
Slika 6. Shema pročišćavanja u ionskim izmjenjivačima
4. Klorirana voda
Voda se klorira da bi se uništili mikroorganizmi koji žive u njoj. Klor je jaki oksidans pa on time i oksidira i sve dodatne nečistoće (organske tvari). Velika mana je da pri tome mogu nastati i potencijalno opasniji organski halogeni spojevi. Voda za piće se klorira zbog humane uporabe. U vodu se dodaje kalcijev hipoklorit (CaOCl) koji u reakciji s vodom disproporcionira (razlaže se) na tzv. nascentni kisik, na vrlo reaktivan kisikov radikal i klorid. Taj klorid nama akvaristima smeta i on se uklanja kemijskom redukcijom sa natrijevim bisulfitom (pripravci za vodu) pri čemu nastaje klor koji polagano isparava (male količine), ali može reagirati i sa amonijakom pri čemu nastaje kloramin. Kloramin također spontano isparava iz vode.
5. Voda provučena kroz granule aktivnog ugljena (voda iz Brite)
To je voda provučena kroz aktivni ugljen koji iz vode dijelom adsorbira otopljene tvari. Adsorbiraju se samo veći ioni, koji su i štetniji. Ima mali kapacitet pročišćavanja vode i ne skida baš previše tvrdoću vode, a adsorbens se mora periodički mijenjati jer se ioni nepovratno vežu za njega.
Franjo Jović, dipl. kem. inž.

