Ugljikov ciklus
- Detalji
- Napisao/la Franjo Jović, dipl. kem. inž.
- Hitova: 32872
 Voda prolazi kroz tlo i stijene te na svom putu otapa različite minerale, koji dižu tvrdoću, i organske tvari. Osim otopljenih tvari u vodi mogu biti prisutne i lebdeće tvari (različite vrste gline, tanini iz drveća i sl.) koje uzrokuju mutnoću. Sve ove tvari u vodi većinom su sastavljene od različitih formi ugljika, od karbonata do kovalentnog ugljika u organskim spojevima. Voda se u akvariju stajanjem onečišćava. Tijekom vremena povećava se sadržaj (koncentracija) otpadnih tvari. Prije svega otpadnim organskim materijalom (aminokiseline, urea, šećeri i sl.), te anorganskim materijalom (karbonati i nitrati). Taj materijal potječe od ostataka hrane, mrtvog lišća biljaka, ribljeg izmeta, ostataka prašine iz zraka, itd. Istovremeno ribe i biljke za svoj rast troše ugljik. Ribe iz hrane koju jedu, a biljke fotosintezom iz ugljičnog dioksida. Ovaj ciklus kruženja tvari u akvariju naziva se ugljikov ciklus. Ipak ako promatramo akvarij kao izoliran sustav moguće je povećanje koncentracije određenih tvari i neravnoteža u ugljikovom ciklusu, posebice u slučaju prenaseljenih akvarija. Pretpostavljamo da postoje određene maksimalno dopuštene koncentracije aniona, kationa i drugih spojeva, kao i broja te vrsti mikroorganizama u akvarijskoj vodi. Ukoliko je kvaliteta akvarijske vode (stupanj onečišćenosti vode) unutar tih granica tijekom određenog vremena, sustavu nije potrebno pročišćavanje. Ipak zbog akvarističkih zahtijeva (veliki broj riba, biljaka i sl.) uglavnom se koriste manje ili više komplicirani sustavi za pročišćavanje (filtraciju). Ukoliko otpadne tvari ne odstranimo voda će vrlo brzo postati toksična i za ribe i za biljke, te će se pretvoriti u smrdljivu tekućinu. Filtracija je potrebna da se osigura prirodno kruženje tvari u izoliranim sustavima. Međutim pokazalo se da se i prirodno zabiljeni akvariji (NPT, Natural Planted Tank) koji su uravnoteženi također mogu ponašati samoodrživima.
Voda prolazi kroz tlo i stijene te na svom putu otapa različite minerale, koji dižu tvrdoću, i organske tvari. Osim otopljenih tvari u vodi mogu biti prisutne i lebdeće tvari (različite vrste gline, tanini iz drveća i sl.) koje uzrokuju mutnoću. Sve ove tvari u vodi većinom su sastavljene od različitih formi ugljika, od karbonata do kovalentnog ugljika u organskim spojevima. Voda se u akvariju stajanjem onečišćava. Tijekom vremena povećava se sadržaj (koncentracija) otpadnih tvari. Prije svega otpadnim organskim materijalom (aminokiseline, urea, šećeri i sl.), te anorganskim materijalom (karbonati i nitrati). Taj materijal potječe od ostataka hrane, mrtvog lišća biljaka, ribljeg izmeta, ostataka prašine iz zraka, itd. Istovremeno ribe i biljke za svoj rast troše ugljik. Ribe iz hrane koju jedu, a biljke fotosintezom iz ugljičnog dioksida. Ovaj ciklus kruženja tvari u akvariju naziva se ugljikov ciklus. Ipak ako promatramo akvarij kao izoliran sustav moguće je povećanje koncentracije određenih tvari i neravnoteža u ugljikovom ciklusu, posebice u slučaju prenaseljenih akvarija. Pretpostavljamo da postoje određene maksimalno dopuštene koncentracije aniona, kationa i drugih spojeva, kao i broja te vrsti mikroorganizama u akvarijskoj vodi. Ukoliko je kvaliteta akvarijske vode (stupanj onečišćenosti vode) unutar tih granica tijekom određenog vremena, sustavu nije potrebno pročišćavanje. Ipak zbog akvarističkih zahtijeva (veliki broj riba, biljaka i sl.) uglavnom se koriste manje ili više komplicirani sustavi za pročišćavanje (filtraciju). Ukoliko otpadne tvari ne odstranimo voda će vrlo brzo postati toksična i za ribe i za biljke, te će se pretvoriti u smrdljivu tekućinu. Filtracija je potrebna da se osigura prirodno kruženje tvari u izoliranim sustavima. Međutim pokazalo se da se i prirodno zabiljeni akvariji (NPT, Natural Planted Tank) koji su uravnoteženi također mogu ponašati samoodrživima.

Slika 1. "Zanemareni" akvarij od 15 L, bez CO2, bez promjene vode tijekom 9 mjeseci, koji nema alge, a riblje zdravlje je izvrsno.(Barr Report Vol. 3, Issue 2, March 2007.)
Kratice
C – koncentracija (mol dm-3)
DIC - organski otopljeni ugljik (eng. Dissolved Inorganic Carbon)
DOC - organski otopljeni ugljik (eng. Dissolved Organic Carbon)
g – plinovito agregatno stanje (eng. gas),
Kd – konstanta disocijacije,
Kr – konstanta reakcije,
Kt – konstanta topljivosti,
l - tekuće agregatno stanje (eng. liquid),
s - čvrsto agregatno stanje (eng. solid),
NPT – prirodno zabiljeni akvarij (eng. natural planted tank)
Bilanca tvari
Bilanca je riječ koja dolazi iz talijanskog jezika u kojem bilancia (čit. bilanča) znači vaga. Temeljno načelo bilance tvari je zakon o neuništivosti materije koji glasi:
"Pri svim kemijskim reakcijama ukupna masa reaktivnih komponenata ostaje nepromijenjena."
Opća jednadžba za bilancu tvari:
ULAZ TVARI – IZLAZ TVARI ± TVAR PROMIJENJENA REAKCIJOM = AKUMULACIJA TVARI
Primjer. Začepljeni kanister filter
Filter uslijed rada i dužeg onečišćenja počeo se zaštopavati, pa je izlaz manji od ulaza čime dolazi do akumulacije u filtru i ako nije zatvoren počet će se prelijevati iz njega.
Ulaz – Izlaz = Akumulacije = Vlažan parket
Ovaj primjer bilance tvari je bez kemijske promjene pa je reakcijski član jednak 0.
Prilikom bilanciranja u kemijskom inženjerstvo osnova kemijskog računa je stehiometrija.
Stehiometrija i konstanta ravnoteže
Stehiometrija je računanje kvantitativnih (mjerljivih) odnosa između reaktanata i produkata u izjednačenim kemijskim reakcijama. Stehiometrija je vrlo važno i korisno polje kemije jer pomaže izračunu koliko se produkata može dobiti iz određenih količina reaktanata, a pri tom uzimajući u obzir i iskorištenje reakcije.
Za reakcija disocijacije vrijedi:
AB ↔ A+ + B-
Konstanta disocijacije je dana omjerom umnoška koncentracija produkata kroz umnožak koncentracije reaktanata.
Kd = c(A+)*c(B-)/c(AB)
Anorganski otopljeni ugljik (DIC)
U akvarijima se od anorganskog ugljika pojavljuju ugljik u oksidacijskom stanju (+4), u dioksidu, karbonatima, te vrlo rijetko u oksidacijskom stanju (+2) u monoksidu. Dakle kada govorimo o karbonatima imamo na umu sve disocirane oblike (H2CO3, HCO3-, CO32-).
Karbonatna kiselina je slaba kiselina i ona disocira u dva stupnja
(1) H2CO3 + H2O ↔ H3O+ + HCO3- pKd1 (25 °C) = 6.37
(2) HCO3- + H2O ↔ H3O+ + CO32- pKd2 (25 °C) = 10.25
Konstanta disocijacije je izražena kao negativni logaritam zbog jednostavnijeg prikazivanja (kao pH otopine).
Karbonate u akvarij unosimo sa vodom, a mjera količine karbonata u vodi je izražena tvrdoćom vode. Karbonati nastaju i reakcijom ugljikovog dioksida sa vodom. Topljivost ugljikovog dioksida je funkcija temperature a ovisnost je prikazana na slici 2.
(3) CO2 (g) ↔ CO2 (l) Kt (25 °C) = 0,8
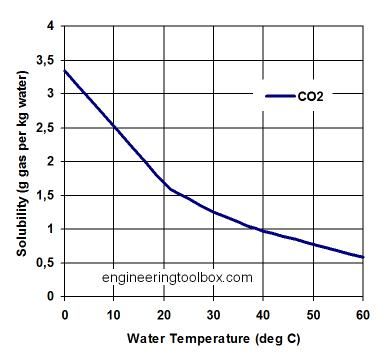
Slika 2. Topljivost ugljikovog dioksida u vodi
(http://www.engineeringtoolbox.com)
Uspostavlja se ravnoteža između otopljenog CO2 i H2CO3.
(4) CO2 (l) + H2O (l) ↔ H2CO3 (l) Kr = 1,7 10-3; Kr = c(H2CO3)/c(CO2)
Ova reakcija je kinetički spora. U ravnoteži samo mali dio (do 1%) od otopljenog CO2 reagira s vodom pri čemu nastaje molekula H2CO3. Većina CO2 ostaje solvatizirana (okružena otapalom) u obliku molekule CO2.
Treba imati na umu da karbonatni anioni mogu reagirati s kationima prisutnim u vodi u obliku netopljivih karbonata. Na primjer ako je prisutan Ca2+ kation nastat će se kamenac (vapnenac) CaCO3, ili ako je prisutan Mg2+ nastat će MgCO3. Formiranje tih netopljivih soli je dodatna pokretačka snaga (Le Chatelierov princip) koja može povući ravnotežu više u desno (reakcija (2) i rezultira zakiseljavanju vode.
(5) Ca2+ + CO32- → CaCO3↓ Kt = 4,96 10-9 (Kt = c(Ca2+)c(CO32-))
(6) Mg2+ + CO32- → MgCO3↓ Kt = 6,82 10-6
Priprema akvarijske vode
Prilikom pripreme akvarijske vode koristimo se formulama za razrjeđenje koje proizlaze iz stehiometrije i bilance. Osnovne formula je dana jednadžbom:
c1 V1 = c2 V2
Priprema lužnate vode (zakiseljavanje)
Želimo pripremiti 100 L akvarijske vode čiji bi pH trebao biti 7. Koristimo vodovodnu vodu čiji je pH = 8, i demineraliziranu RO vodu čiji je pH 6,3.
Bilanca tvari (za H+ ione glasi): n(H+)ukupno = n(H+)vodovodna + n(H+)RO
pHakv Vakv = pHvodovodne Vvodovodne + pHRO VRO
pHakv Vakv = pHvodovodne (Vakv - VRO) + pHRO VRO
VRO = Vakv (pHvodovodne - pHak)/( pHvodovodne - pHRO)
VRO = 100 L (8 - 7)/(8 - 6,3) = 58,8 L
Za pripremu 100 L akvarijske vode pH = 7 biti će nam potrebno 58,8 L RO vode.
Priprema tvrde vode (omekšavanje)
U kanistru od 20 L želimo pripraviti vodovodnu vode ukupne tvrdoće 20 dH (≈ 180 mg L-1) za izmjenu u akvariju. Vodu pripremamo zagrijavanjem tijekom određenog vremenskog perioda.
Bilanca za karbonate:
m(CO32-)ulaz – m(CO32-)reakcija = m(CO32-)akumulacija; Izlaz = 0;
Pretpostavka je da karbonati u vodenom sustavu potpuno hidroliziraju (reakcija (2)):
CO32- + H+ → HCO3-
Zagrijavanjem vode topljivost ugljikovog dioksida pada, i to grijanjem od 18oC do 40 oC pada za duplo, sa 2 g L-1 na 1 g L-1 (slika 2.).
Zbog smanjene topivosti CO2 izlazi iz otopine (isparava) i narušava se ravnoteža:
2HCO3- + Ca2+ → CaCO3↓(s) + H2O + CO2↑(g)
Ovaj isti proces se događa tijekom kuhanja, a u loncima se taloži kamenac, odnosno CaCO3.
Kako vrijedi Le Chatelierov princip, zbog gubljenja CO2 sve više će se hidrogenkarbonata raspadati, pri čemu će se taložiti kalcijev karbonat u kanistru, uz istovremeno smanjivanje karbonatne tvrdoće vode. Iz stehiometirje vrijedi:
n(CO32-)reakcija = n(HCO3-)= n(CaCO3)taložen= n(CO2)isparen
Uz pretpostavku da je isparilo samo 50 mL CO2 tvrdoća će se smanjiti:
V(CO2)= 100 mL → m = ρ V → m(CO2)= 200 mg → n = m/M → n(CO2)= 0,0046 mol
n(CO32-)reakcija = 0,0046 mol → m(CO32-) reakcija = 273 mg
Vratimo se na bilancu:
m(CO32-)ulaz – m(CO32-) reakcija = m(CO32-) akumulacija
m(CO32-)akumulacija = 3600 mg – 273 mg = 3327 mg → γ(CO32-) = 166 mg L-1 → kH = 10
Otapanje CO2 u akvariju
U akvarij od 100 L bez bilja uvodimo CO2 3 mjehurića u sekundi (10 mL s-1) koji se dijelom apsorbiraju u vodi i iz akvarija izlazi 1 mjehurić po sekundi (5 mL s-1).
n(CO2) ulaz – n(CO2) izlaz = n(CO2) akumuliran; n(CO2) promijenjen reakcijom = 0 (jer nema biljaka);
n = pV/RT = 101325 Pa 5 10-3 L s-1 10-3 m3 L-1 / 8,314 J mol-1 K-1 298 K = 0,0002 mol s-1
tijekom 1 sata se akumulira n(CO2) = 0,736 mol
u akvariju je koncentracija (c = n/V) c(CO2) = 7,36 10-3 mol L-1
Konstanta ravnoteže hidratacije pri 25°C u slučaju ugljične kiseline iznosi Kr=1,70 10-3 (http://en.wikipedia.org/wiki/Carbonic_acid).
c(H2CO3)/c(CO2) = Kh = 1,70 10-3 → c(H2CO3) = Kr c(CO2)
c(H2CO3) = 1,25 10-5
Za prvi stupanj disocijacije ugljične kiseline (reakcija (1)) konstanta dis. je Kd1 = 4,45 10−7.
Kd1 = c(H+) c(HCO3-)/c(H2CO3)
Uz pretpostavku da je početna karbonatna tvrdoća bila nula, vrijedi c(H+) = c(HCO3-)
c(H+)2 = Kd1 c(H2CO3)
c(H+) = 0,00057 mol L-1
pH = 3,24
Zbog postojanja pufera (velika tvrdoća vodovodne vode) vrlo je rijetko je moguće ovoliko sniziti pH. Ta ista činjenica nas zapravo štiti od procesa koji se naziva zakiseljavanje oceana, zbog povećane količine ispušnih plinova uslijed korištenja fosilnih goriva.
Uz pretpostavku da je početna ukupna tvrdoća vodovodne vode jednaka karbonatnoj tvrdoći, kH = 10. Kako je 1 °dH ekvivalentan γ(CaCO3) = 17,86 mg dm-3, može se izračunati količinska koncentracija c(CaCO3) = γ(CaCO3)/M((CaCO3).
c(CaCO3) = 1,786 10-3 mol L-1
Uz pretpostavku disocijacije kalcijevog karbonata i potpune hidrolize karbonata:
CO32- + H+ → HCO3-
c(HCO3-) = 1,786 10-3 mol L-1
c(H+) = Kd1 c(H2CO3)/c(HCO3-)
pH = 7,81
Isti primjer za akvarij sa biljakama i uz pretpostavku stacionarnog stanja (akumulacije = 0) bilo bi potrebno poznavati točnu količini CO2 koji koriste biljke i točnu količinu koja se otapa. U praksi je to teško znati.
Podešavanje pH vode pomoću karbonata (uz CO2)
Osnovne jednadžbe potrebne za izračunavanje pH su izvedene iz jednadžbi (1) i (2). Kako su to komplicirane jednadžbe (potrebno je riješiti sustav 5 jednadžbi s 5 nepoznanica), rješenje ćemo prikazati grafičkim prikazom (slika 3.).
Posebice mnogi akvaristi u želji da reguliraju pH vode svoga akvarija čine grešku jer ne poznaju ponašanje pufersko ponašanje karbonatnih otopina (tvrde vode).
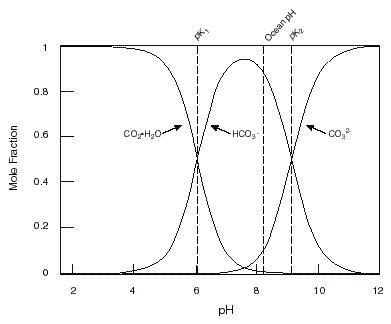
Slika 3. Odnos pH i otopljenog CO2
Puferska otopina karbonata djeluje u 3 područja i limitirana je konstantama disocijacije karbonatne kiseline (Kd1 i Kd2) kako se to vidi iz slike 3. U Hrvatskoj imamo tvrdu i blago lužnatu vodu (vodovodna voda), dakle bogata HCO3- i obično joj želimo povećati kiselost, dakle sniziti pH, pufer će djelovati u smjeru nastajanja H2CO3 (reakcija (1) u lijevo), pri čemu će se trošiti H+ ioni (koji daju kiselost). Ukoliko (teorijski) želimo povisiti pH, smanjiti kiselost (uklanjati H+ ione), pufer će djelovati u smjeru disocijacije HCO3- pri čemu će nastajati CO32- i H+ ioni (reakcija (2) u desno). Pri tome treba imati u vidu da na snižavanje pH utječe još jedna reakcija (4), nastajanje CO2, i da će Le Chatelierov princip vući reakciju i lijevo. Također pri povišavanju pH također utječe još jedna reakcija (5), taloženje CaCO3, a nju će Le Chatelierov princip vući u desno (slika 4.).
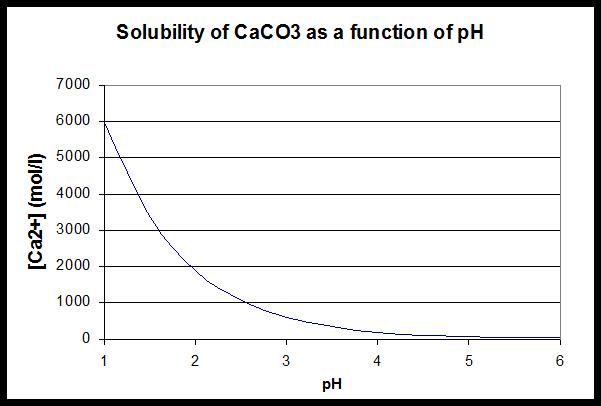
Slika 4. Ovisnost pH i topljivost CaCO3
Organski otopljeni ugljik (DOC)
Do sada smo govorili samo o ugljikovom dioksidu i karbonatima koji sačinjavaju anorganski dio ugljika. Međutim kako je ugljik je osnovni element pomoću kojeg je ostvaren život na Zemlji, svi živi organizmi trebaju ugljik kao izvor hrane. Ciklusa ugljika uključuje procese koji su važna veza između abiotske (nežive) i biotske (žive) komponente vodenih ekosustava.
Organski oblik ugljika se sastoji od dugih lanaca ili prstenova ugljika međusobno povezanih kovalentnom vezom. Raznolikost organskih spojeva se ostvaruje zbog sposobnosti ugljikovih atoma da ostvari mnogo različitih međusobnih veza i veza s drugim nemetalima kao što su vodik , dušik, kisik, sumpor ili halogeni elementi.
Ciklus ugljika uključuje prijelaz između različitih oksidacijskih stanja ugljika i pod utjecajem su brojnih fizikalno-kemijskih čimbenika kao što su svjetlo, temperatura, otopljeni kisik, pH, redoks potencijal, ionske sastav vode, kao i biološki čimbenici kao što su produktivnost (slika 5.).
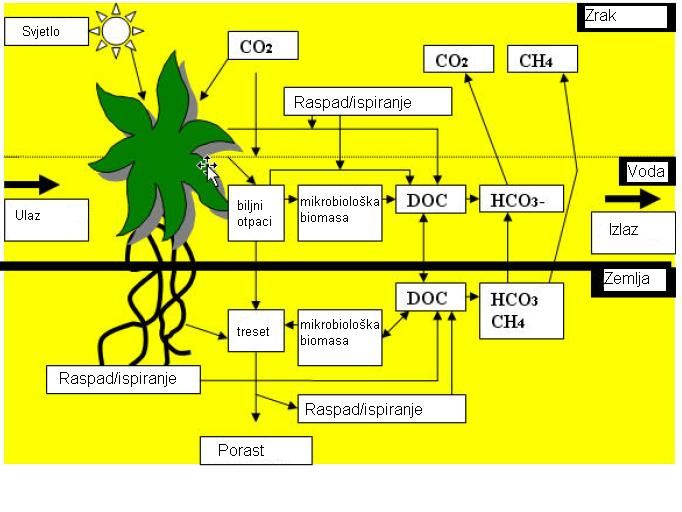
Slika 5. Ciklus ugljika (Barr Report Vol. 1, Issue 4, April 2005.)
Osnovna stanja ugljika su ugljični dioksid (CO2) kao produkt respiracije (staničnog disanja), metan (CH4) kao produkt anaerobnog raspada (bez prisutnosti zraka), i glukoza (C6H12O6) kao produkt fotosinteze u stanicama biljaka. U tablici 1. su prikazane različite forme ugljika od aminokiselina (koje su sastavni dijelovi proteina), šećera (produkt fotosinteze) do ugljičnog dioksida.

Tablica 1. Forme ugljika u akvarijskoj vodi
U akvarijskoj vodi tijekom dolazi do akumulacije otpadnih organskih tvari. Osim toga vrlo često se uvodi ugljični dioksid u akvarij zbog potreba i bržeg rasta biljki. Da bi količinu ugljika održali stalnom u akvariju potrebno je vodu filtrirati. U primarnom stupnju filtracije, uklanjaju se netopive čestice, obično mrtvog organskog materijala. Biološki postupak provodi se u sekundarnom stupnju obrade akvarijske vode u aeriranom filtru i služi za uklanjanje organskih otopljenih tvari pomoću mikroorganizama (slika 6.).
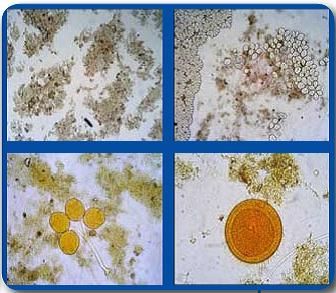
Slika 6. Mikrorganizmi u aktivnom mulju
(Andrassy: "Tehnologija s ekologijom", Zagreb, 2010.)
U aerobnim uvjetima mikroorganizmi uklopljeni u pore spužve filtera ili keramičke valjke oksidiraju organsku tvar (mineralizacija) u otpadnoj vodi pri čemu nastaje velika količina aktivnog mulja (nove stanice). Ova transformacija može se prikazati sljedećom jednadžbom:
organska tvar + O2 + mikroorganizmi → CO2 + H2O + NH3 + nove bakterije
Kao što vidimo i raspad organske otopljene tvari također utječe na karbonatni pufer akvarijske vode jer se oslobađa CO2. U dobro zabiljenim akvarijima (NPT) koji prije svega uravnoteženi, biljke troše CO2 za fotosintezu i kao što vidimo ciklus ugljika se time zatvara.
Zbog raspadanja aminokiselina koji se nalaze u proteinima biljaka nastaje amonijak, uz ureu koju ispuštaju ribe kao produkt metabolizma dolazimo do drugog važnog ciklusa u akvarijumu, a to je dušikov ciklus.
Zaključak
Uravnotežene akvarije vode prirodni principi, karbonatni pufer, topljivost CO2, netopljivost CaCO3, aerobna razgradnja, fotosinteza. Narušavanjem toga principa nastaju problemi npr. kloriranje vodovodne vode, uvođenje CO2 zbog boljeg rasta biljaka, velika tvrdoća vode, prenapučeni akvariji, uporaba RO vode, te pokušaj prisilne regulacije pH. Boljim razumijevanjem kemije akvarija može se doprinijeti većoj ravnoteži i skladu u akvariju.